Перейти к:
Интегральная диагностическая шкала в хирургии щитовидной железы
https://doi.org/10.14341/serg12841
Аннотация
ОБОСНОВАНИЕ. Увеличение числа больных узловыми образованиями щитовидной железы (ЩЖ) обуславливает необходимость детального изучения диагностических возможностей, способствующих повышению качества их дооперационной верификации и выбору оптимальной тактики лечения. В связи с этим продолжается активное усовершенствование и внедрение новых высокотехнологичных методик, которые требуют обоснования эффективности их применения в клинической практике.
ЦЕЛЬ. Разработать интегральную диагностическую шкалу оценки риска злокачественности узловых образований ЩЖ, способствующей выбору оптимального варианта хирургического лечения.
МАТЕРИАЛЫ И МЕТОДЫ. С целью оценки обоснованности лечебно-диагностической тактики и выбора оптимального объема хирургического вмешательства с разработкой оригинальной интегральной диагностической шкалы проведен ретроспективный анализ результатοв οбследοвания и лечения 244 бοльных с узловыми образованиями ЩЖ, а также прοспективнοе исследование, включающее 65 клинических наблюдений.
РЕЗУЛЬТАТЫ. В ходе проведенного исследования реализован системный подход к дифференциальной диагностике узловых образований ЩЖ с использованием наиболее эффективных современных методов лабораторно-инструментального обследования в рамках разработки оригинальной интегральной шкалы. Доказано, что применение интегральной диагностической шкалы позволяет прогнозировать риск злокачественности образований: низкий (3–7%) при 0–5 баллах, средний (7–35%) — 6–10, повышенный (35–80%) — 11–15, высокий (80–96%) — 16–20. Установлено, что у больных с повышенным и высоким риском злокачественности диагностическая точность предложенной интегральной шкалы в выявлении высокодифференцированного рака щитовидной железы возрастает до 90,2% при определении экспрессии Galectin-3 выше 31,2% в пункционном материале, а также папиллярной карциномы — до 100% при выявлении мутации BRAF V600E. Оптимизирован лечебно-диагностический алгоритм для клинического применения, позволяющий индивидуализировать лечебную тактику: пациентам с повышенным и высоким риском злокачественности целесообразно выполнение тиреоидэктомии с центральной лимфаденэктомией; со средним риском — гемитиреоидэктомии; с низким риском при отсутствии признаков компрессии органов шеи — динамическое наблюдение, а при его наличии — резекции ЩЖ. Показано, что реализация модифицированного лечебно-диагностического алгоритма с учетом применения интегральной диагностической шкалы обеспечивает хорошие непосредственные результаты лечения.
ЗАКЛЮЧЕНИЕ. Внедрение усовершенствованного лечебно-диагностического алгоритма с учетом применения интегральной шкалы комплексной лабораторно-инструментальной оценки узловых образований ЩЖ позволяет повысить эффективность их дооперационной дифференциальной диагностики и выбрать индивидуализированный вариант хирургического лечения.
Ключевые слова
Для цитирования:
Ромащенко П.Н., Майстренко Н.А., Криволапов Д.С., Симонова М.С. Интегральная диагностическая шкала в хирургии щитовидной железы. Эндокринная хирургия. 2024;18(3):12-23. https://doi.org/10.14341/serg12841
For citation:
Romashchenko P.N., Maistrenko N.A., Krivolapov D.S., Simonova M.S. Integral diagnostic scale in thyroid surgery. Endocrine Surgery. 2024;18(3):12-23. (In Russ.) https://doi.org/10.14341/serg12841
Обоснование
Диагностика узловых образований щитовидной железы (УОЩЖ) остается одной из сложных и актуальных проблем эндокринной хирургии [1–3]. Несмотря на совершенствование диагностических исследований, способствующих раннему выявлению рака ЩЖ (РЩЖ) и фолликулярных неоплазий, сохраняются трудности определения индивидуальных морфологических и молекулярно-биологических характеристик опухолей до операции, что обуславливает особенности развития и течения заболевания, чувствительность к проводимому лечению [4][5]. Анализ литературных данных, направленных на изучение эффективности применяемых в настоящее время современных методов исследования, показал, что они не могут иметь самостоятельного решающего значения в диагностике УОЩЖ, что требует системного и интегрального подхода к их оценке [6][7]. В мировой литературе известны единичные разработки комплексных диагностических алгоритмов, основанных на ультразвуковых, цитологических и генетических характеристиках образований, позволяющих стратифицировать риск их злокачественности [8–10]. Развитие и совершенствование цифровых технологий с разработкой и внедрением оценочных шкал, способных стандартизировать лечебно-диагностическую тактику путем «балльного» подхода, давно нашло применение в различных областях медицины. Однако в эндокринологии и хирургии щитовидной железы (ЩЖ) по-прежнему не существует диагностической шкалы с интегральной оценкой результатов современных методов лабораторно-инструментального обследования, позволяющей стратифицировать УОЩЖ и обосновать выбор объема хирургического вмешательства. Указанные аспекты определяют необходимость дальнейшего изучения новых высокотехнологичных методов предоперационной диагностики УОЩЖ с разработкой диагностических шкал, учитывающих интегральную оценку результатов ведущих лабораторно-инструментальных методов обследования, способствующих выбору обоснованного персонифицированного варианта лечения с целью улучшения его результатов.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Разработать интегральную диагностическую шкалу комплексной оценки риска злокачественности УОЩЖ, способствующей выбору оптимального варианта хирургического лечения, и обосновать ее применение в клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Клиника факультетской хирургии им. С.П. Федорова ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» МО РФ, г. Санкт-Петербург, Россия.
Время исследования. Ретроспективный этап исследования проведен в период с января по август 2022 г., проспективный — с сентября 2022-го по февраль 2023 гг.
Изучаемые популяции (одна или несколько)
В работу включены результаты обследования и лечения отобранных 309 пациентов с различными УОЩЖ (244 — ретроспективного, 65 — проспективного этапов исследования).
Критерии включения: наличие у больных УОЩЖ, требующих хирургического лечения.
Критерии исключения: больные диффузным токсическим зобом, медуллярным, низкодифференцированным РЩЖ, распространенными формами высокодифференцированного РЩЖ, а также с выраженной сопутствующей патологией (IV балла согласно классификации Американской ассоциации анестезиологов (ASA).
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборки были сформированы путем сплошного включения наблюдений.
Дизайн исследования
Исследование состояло из двух этапов. На первом ретроспективно осуществлена оптимизация предоперационной диагностики УОЩЖ путем исследования современных методов диагностики, в том числе молекулярно-генетических с оценкой уровня экспрессии Galectin-3, NIS и мутации V600E гена BRAF в клеточном материале у 244 больных УОЩЖ с разработкой оригинальной диагностической шкалы; на втором изучены результаты ее проспективного применения у 65 пациентов в рамках апробации усовершенствованного лечебно-диагностического алгоритма.
Методы
Комплексное дооперационное обследование больных осуществлялось согласно российским клиническим рекомендациям и включало оценку результатов объективного осмотра, совокупность предоперационного лабораторного анализа гормонального фона ЩЖ, инструментальные неинвазивные (ультразвуковое исследование (УЗИ) ЩЖ, сцинтиграфия ЩЖ с 99mTc-пертехнетатом, двухиндикаторная сцинтиграфия с 99mТс-пертехнетатом и 99mТс-технетрилом, мультиспиральная компьютерная томография (МСКТ) шеи и груди, рентгеноскопия пищевода с контрастированием сульфатом бария) и инвазивные методы (пункционная тонкоигольная аспирационная биопсия (ПТАБ) с цитологическим и молекулярно-генетическим исследованием полученного материала), а также консультации специалистов: терапевта (по показаниям) и оториноларинголога (всем больным) [11].
Сцинтиграфию ЩЖ и области шеи с 99mTc-пертехнетатом выполняли для дифференциальной диагностики диффузного и узлового токсического зоба, а также изучения топографоанатомических особенностей ЩЖ. С целью дифференциальной диагностики УОЩЖ у ряда больных применяли динамическую двухиндикаторную сцинтиграфию с 99mТс-пертехнетатом и туморотропным радиофармпрепаратом (РФП) —99mТс-технетрилом, основанную на визуальном (качественном) и полуколичественном анализе данных. Интерпретацию результатов осуществляли по модифицированным методикам, основанных на выделении трех моделей УОЩЖ в зависимости от визуального поглощения ими 99mТс-пертехнетата и 99mТс-технетрила в раннюю и позднюю фазы сканирования: модель 1 — поглощение 99mТс-технетрила меньше поглощения 99mТс-пертехнетата; модель 2 — поглощение 99mТс-технетрила больше поглощения 99mТс-пертехнетата в раннюю фазу сканирования; поглощение 99mТс-технетрила в раннюю фазу больше поглощения 99mТс-технетрила в позднюю фазу; модель 3 — поглощение 99mТс-технетрила выше поглощения 99mТс-пертехнетата в раннюю фазу; поглощение 99mТс-технетрила в раннюю фазу соответствует поглощению 99mТс-технетрила в позднюю; а также расчете индекса вымывания туморотропного РФП. «Горячие» УОЩЖ, а также соответствующие 1 модели, считали доброкачественными; узлы, относящиеся ко 2 модели, имели низкий риск злокачественности, к 3-й — высокий. Индекс вымывания более 20% соответствовал доброкачественному характеру УОЩЖ, а менее 20% — злокачественному [6].
Для уточнения молекулярно-биологических характеристик УОЩЖ проводили иммуноцитохимические и молекулярно-генетические исследования клеточного материала, полученного при ПТАБ. Оценку экспрессии онкомаркера Galectin-3 и натрий-йодидного симпортера (NIS) осуществляли по усовершенствованной методике проточной флуоцитометрии (ПФЦ) при помощи специфичных для каждого маркера антител. Определение соматической мутации V600E гена BRAF в аспирате проводили по общепризнанной методике аллель-специфичной полимеразной цепной реакции (ПЦР) [11].
В проспективной группе обследование больных осуществлялось с учетом современных классификационных позиций, а также молекулярно-генетических методов исследования с определением экспрессии Galectin-3 и выявлением мутации V600E гена BRAF в пункционном материале УОЩЖ. После комплексного обследования проводили интегральную оценку ведущих критериев, позволяющих обосновать показания к хирургическому лечению, выбор методики и объема предстоящей операции, которые определяли согласно российским и международным клиническим рекомендациям [12][13].
Статистический анализ
Статистическую обработку полученных данных проводили на персональном компьютере с помощью пакета прикладных программ Microsoft Excel (Microsoft Office 2013, США) и STATISTICA for Windows 7,0. Осуществляли определение числовых характеристик исследуемых данных и традиционных показателей описательной статистики. Достоверность различий переменных в выборках оценивали по t-критериям Стьюдента и Фишера (достоверным считали различие при p<0,05 и f<0,05). Оценку показателей диагностической значимости методов исследования осуществляли по чувствительности, специфичности, точности, положительной и отрицательной прогностической ценности. С целью изучения связи между двумя количественными рядами изучаемых признаков использовали коэффициент ранговой корреляции Спирмена. Оценку эффективности бинарных классификаторов на основе логистической регрессии осуществляли методом ROC-анализа (Receiver Operator Characteristic) с определением порога или точки отсечения (cut-off value) и площади под кривой Area Under Curve (AUC). Значение AUC 1.0 принимали за «идеальную» модель.
Этическая экспертиза
На проведение данного исследования с участием человека получено разрешение независимого этического комитета при ВМедА им. С.М. Кирова (выписка из протокола №271 от 20 ноября 2022 г.).
Результаты
Ретроспективное исследование
По результатам оценки клинических проявлений, у больных УОЩЖ ретроспективной группы (n=244) установлено, что у большинства из них — 146 (59,8%) — отсутствовала клиническая картина заболевания ЩЖ, у 76 (31,1%) — отмечены компрессионный синдром и косметический дефект, у 17 (7%) — симптомы, обусловленные гормональными изменениями, у 5 (2,1%) — сочетание признаков компрессии органов шеи и нарушения гормональной функции ЩЖ.
Оценка ультразвуковых характеристик УОЩЖ с интерпретацией результатов в рамках международной классификационной системы TIRADS (2011 г.) была применена у 203 пациентов (83,2%) и позволила выявить подозрительные в отношении злокачественности признаки у 132 (65%) больных: TIRADS 4a (один признак) — у 54 пациентов; TIRADS 4b (2 признака) — у 35; TIRADS 4c (3 признака) — у 26; TIRADS 5 (4–5 признаков) — у 17. У 71 (35%) больного при первичной сонографической оценке образований риск злокачественности был низкий (TIRADS 3) или отсутствовал (TIRADS 2).
С целью уточнения предоперационного морфологического диагноза всем пациентам выполнена ПТАБ УОЩЖ с описанием цитологических результатов согласно международной классификации The 2017 Bethesda System for Reporting Thyroid Cytopathology (BSRTC, 2018 г.), включающей 6 диагностических категорий. У 53 (21,7%) больных клеточный материал соответствовал злокачественной опухоли, у 11 (4,5%) — подозрению на нее, у 140 (57,4%) — фолликулярной неоплазии, у 40 (16,4%) — доброкачественным УОЩЖ. У 6 пациентов были пунктированы подозрительные регионарные лимфатические узлы.
МСКТ шеи и груди с контрастным усилением была выполнена 48 (21,4%) больным, у 27 из которых при УЗИ заподозрено экстратиреоидное распространение опухолевого процесса или изменение регионарных лимфатических узлов, а также при размерах карциномы более 4 см. У 7 пациентов подтверждены данные, указывающие на экстратиреоидный рост образования, у 9 — регионарное метастазирование. У 15 больных узловым коллоидным зобом по результатам исследования отмечено оттеснение трахеи и гортани на различных уровнях, у 6 — сужение их просвета.
Сцинтиграфия ЩЖ с 99mТс-пертехнетатом была выполнена у 31 (12,7%) пациента и позволила уточнить топографоанатомические особенности ЩЖ при ее шейно-загрудинной локализации у 22 больных, а также подтвердить диагноз узлового токсического зоба у 9. С целью дифференциальной диагностики УОЩЖ у 15 (6,1%) пациентов была применена модифицированная методика двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом, основанная на визуальном и полуколичественном анализе данных с расчетом индекса вымывания 99mТс-технетрила [6]. При оценке полученных сцинтиграфических данных активное накопление РФП в УОЩЖ, соответствующее 2 и 3 моделям (промежуточному и высокому риску злокачественности), отмечено у 7 и 6 больных соответственно. При этом разброс индекса вымывания 99mТс-технетрила в раннюю и позднюю фазы сканирования составил от 6,7 до 42,8%, в среднем — 20,6±9,2%. У двух пациентов с функционирующими («теплыми») коллоидными узлами было отмечено менее интенсивное накопление туморотропного РФП, что позволило отнести данные УОЩЖ к 1 модели.
С целью улучшения качества дооперационной диагностики общепринятый комплекс обследования был дополнен молекулярно-генетическими методами исследования пункционного материала с определением экспрессии онкомаркера Galectin-3 и выявлением мутации V600E гена BRAF у 112 из 244 больных гормонально неактивными УОЩЖ, оценкой уровня экспрессии NIS — у 66. Так, уровень экспрессии Galectin-3 колебался от 0,4 до 89,9% и в среднем составил 38,2±20,1%. Мутация V600E гена BRAF в аспирате УОЩЖ выявлена у 30 (26,7%) больного с цитологически подтвержденным высокодифференцированным РЩЖ (ВДРЩЖ) (n=25) или подозрением на него (n=3) и фолликулярными неоплазиями (n=2). Оценка мембранной экспрессии NIS в клеточном материале, полученном при ПТАБ, у 66 больных ретроспективного исследования позволила установить, что его значения среди доброкачественных и злокачественных образований находились в пределах от 0,4 до 12,2% со средним значением 3,3±1,8% и не имела дифференциально-диагностического значения в их дооперационной верификации.
По результатам комплексного обследования больных ретроспективного исследования, были сформулированы показания к хирургическому лечению, основную часть которых составили фолликулярные опухоли — 135 (55,3%), ВДPЩЖ и подозрение на него — 64 (26,2%), нетоксический узловой зоб с компрессией органов шеи — 31 (12,7%), токсический узловой зоб — у 9 (3,7%), узловая гипертрофическая форма хронического аутоиммунного тиреоидита с компрессией органов шеи — у 5 (2%).
Тиреоидэктомию выполняли при ВДРЩЖ размером более 2 см (T2) или любого размера с признаками экстратиреоидного роста опухоли (T3) и при наличии образований в обеих долях ЩЖ (n=76); гемитиреоидэктомию — при небольших карциномах (T1) и поражении одной доли фолликулярной опухолью (n=155); субтотальную резекцию ЩЖ различного объема — у пациентов с токсическими аденомами и доброкачественными коллоидными узлами, осложненными компрессионным синдромом, в зависимости от вовлечения долей в патологический процесс. Выполнение завершающей тиреоидэктомии с центральной лимфаденэктомией (ЦЛАЭ) понадобилось у 4 больных после первой органосберегающей операции в связи с экстратиреоидным распространением ВДРЩЖ и наличием регионарных метастазов в лимфатических узлах VI группы по результатам гистологического исследования.
Хирургическое вмешательство у 40 больных было дополнено ЦЛАЭ (n=31) при до- или интраоперационном подозрении на наличие вторичных изменений в VI группе лимфатических узлов шеи, а также ЦЛАЭ с боковой лимфаденэктомией (БЛАЭ) (n=9) — при подозрении на метастазирование в боковые шейные лимфатические узлы по данным МСКТ. Наличие метастазов в VI группе лимфоузлов подтверждено у 18 из 40 пациентов, в боковых шейных (II, III, IV или V группе) — у 8 из 9 больных.
С применением открытой традиционной техники хирургического вмешательства прооперированы 75 (30,7%) пациентов; минимально инвазивной эндоскопически-ассистированной — 137 (56,1%); минимально инвазивной неэндоскопической — 32 (13,1%) с интраоперационным нейромониторингом (ИОНМ) во всех случаях. Потери или ослабления сигнала при мониторировании гортанных нервов отмечено не было.
Осложнения в послеоперационном периоде возникли у 31 (12,7%) пациента и были представлены нарушениями функции гортани (n=12) вследствие транзиторного повреждения возвратного гортанного нерва (ВГН) при его тракции: функциональная дисфония отмечена у 7 пациентов, односторонний парез мышц гортани — у 5, а также транзиторным гипопаратиреозом с гипокальциемией (n=16), связанными с нарушением кровоснабжения или удалением нескольких околощитовидных желез при выполнении ЦЛАЭ. У 3 пациентов во время минимально инвазивных вмешательств (MIVAT — 1; MIT — 2) недостаточный гемостаз привел к возникновению гематом в области операции, которые потребовали проведения их пункции.
Гистологическое исследование операционного материала позволило подтвердить окончательный диагноз BДPЩЖ у 49 (92,5%) больных из 53 с цитологически подтвержденным PЩЖ (Bethesda VI), у 10 (90,9%) из 11 — с подозрением на него (Bethesda V). У 5 пациентов указанных диагностических категорий были верифицированы фолликулярные аденомы. В группе больных фолликулярными неоплазиями (Bethesda IV) (n=140) — у 124 (88,6%) гистологически были определены фолликулярные аденомы, у 3 (1,5%) — коллоидный зоб, у 13 (9,3%) — BДPЩЖ. У 33 (82,5%) из 40 больных с цитологическим заключением «коллоидного зоба» подтверждено наличие доброкачественного процесса в виде разной степени пролиферирующего коллоидного зоба (n=28) и аутоиммунного тиреоидита (n=5), у 5 (12,5%) — фолликулярных аденом. У 2 (5%) больных узловой гипертрофической формой аутоиммунного тиреоидита (АИТ) и многоузловым шейно-загрудинным токсическим зобом после тиреоидэктомии выявлены ПКЩЖ.
При оценке корреляции данных УЗИ и гистологического исследования установлено, что РЩЖ выявлен у 66 (50%) из 132 больных с подозрительными на злокачественность сонографическими характеристиками. Применение в клинической практике классификационной системы TIRADS позволило добиться высоких показателей диагностической значимости данного метода: чувствительность, специфичность, точность, положительная и отрицательная прогностическая ценность составили 95,7%; 50,7%; 66%; 50% и 95,8% соответственно. Чуть более высокие значения чувствительности (97,3%) и отрицательной прогностической ценности (95%) в отношении ВДРЩЖ были достигнуты при ПTAБ с цитологическим исследованием полученного материала. Однако с учетом группы фолликулярных опухолей (Bethesda IV) данный метод имеет низкую специфичность (22,4%), точность (45,1%) и положительную прогностическую ценность (35,3%).
При оценке эффективности модифицированной визуальной методики динамической двухиндикаторной сцинтиграфии ЩЖ с 99mТс-пертехнетатом и 99mТс-технетрилом установлено, что у 5 (83,3%) из 6 больных, отнесенных к модели 3, указывающей на злокачественность, подтверждено наличие папиллярного РЩЖ (ПРЩЖ). У 4 из 7 пациентов, соответствующих 2 промежуточной модели, были верифицированы фолликулярные аденомы (n=3) и коллоидный зоб (n=1), у 3 — ПРЩЖ. У всей больной модели 1 был подтвержден доброкачественный характер УОЩЖ. Чувствительность, специфичность, точность, положительная и отрицательная прогностическая ценность визуальной методики сцинтиграфии составили 62,5%; 85,7%; 73,3%; 83,3% и 66,7% соответственно.
Изучение диагностической значимости полуколичественной методики двухиндикаторной сцинтиграфии ЩЖ у больных 2 и 3 моделей с учетом установленных пороговых значений индекса вымывания 99mТс-технетрила для дифференцирования доброкачественных и злокачественных УОЩЖ позволило установить, что у всех пациентов с окончательно подтвержденным РЩЖ его уровень не превышал 20%. Значения индекса от 20 до 40% соответствовали фолликулярным аденомам, у 1 больного коллоидным зобом его уровень составил 42,8%. Исключение составил лишь 1 пациент с В-клеточной аденомой, поглощение РФП в которой не отличалось от папиллярных карцином и составило 19%. Чувствительность, специфичность, точность, положительная и отрицательная прогностическая ценность полуколичественной методики сцинтиграфии составили 100%; 80%; 92,3%; 88,9% и 100% соответственно, что превышает таковые при модифицированном визуальном анализе данных. При исключении В-клеточной аденомы все показатели информативности данного метода диагностики достигают 100% (р<0,05).
Определение Galectin-3 методом ПФЦ позволило установить, что среди 46 больных с гистологически подтвержденным BДPЩЖ его экспрессия находилась в пределах от 31,2 до 89,9%, в среднем составила 56,1±11,4%. Лишь у двух пациентов c ПРЩЖ были отмечены исключительно низкие уровни экспрессии Galectin-3 — 12,3 и 9,5%, у одного из которых был диагностирован его фолликулярный вариант. В то же время у больных фолликулярными карциномами выявлены самые высокие значения экспрессии данного маркера — 79,6; 85,6 и 89,9%. Большой разброс значений экспрессии Galectin-3 — от 0,4 до 59,5% — отмечен у пациентов с фолликулярными аденомами ЩЖ, среди которых средний показатель составил 26,1±15,8%. У всех 18 больных коллоидным зобом уровень экспрессии Galectin-3 был не выше 28,3%.
Оптимальная отсечка по данным ROC-анализа для разделения доброкачественных и злокачественных УОЩЖ по уровню экспрессии Galectin-3 установлена на уровне 31,2%. Изучение диагностической значимости позволило установить, что чувствительность определения уровня Galectin-3 составила 95,7%, специфичность — 86,4%, точность — 90,2%, положительная и отрицательная прогностическая ценность — 83,0% и 96,6% соответственно (AUC=0,934) (рис. 1, 2).
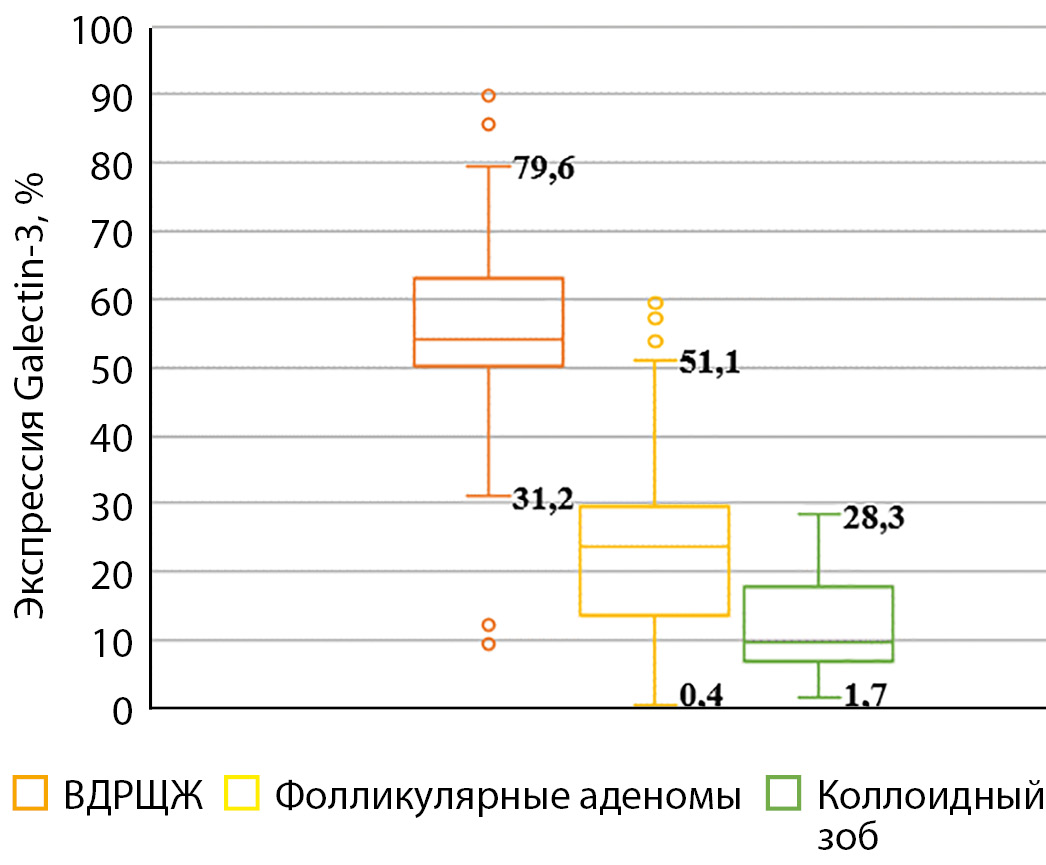
Рисунок 1. Результаты исследования экспрессии Galectin-3 в доброкачественных и злокачественных УОЩЖ.
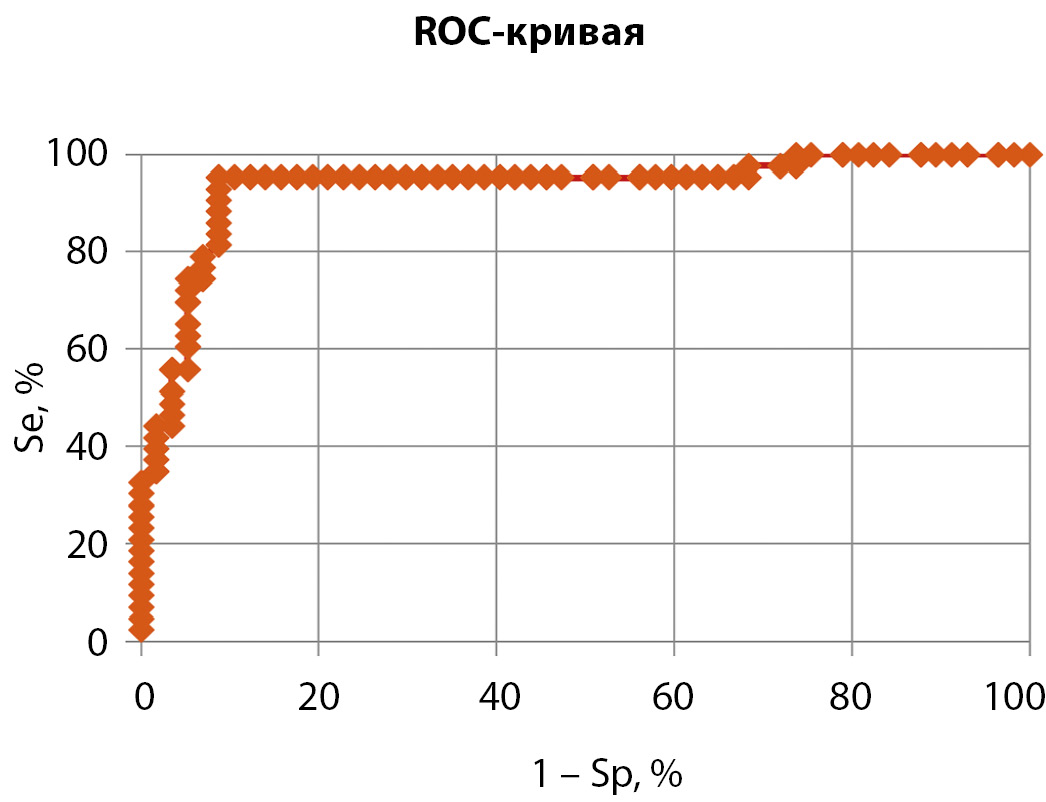
Рисунок 2. ROC-анализ эффективности исследования экспрессии Galectin-3 в дифференциальной диагностике УОЩЖ.
Проведенный анализ результатов оценки Galectin-3 в диагностических группах больных согласно цитологическим заключениям показал, что среди больных с цитологически подтвержденным РЩЖ (n=37) и подозрением на него (n=7) низкие значения экспрессии данного маркера в 3 случаях (9,5, 10,2 и 12,3%) указывали на доброкачественный характер УОЩЖ, однако результаты цитологического исследования определяли онкологические показания для активной хирургической тактики. Среди 51 пациента с фолликулярными неоплазиями у 37 (72,5%) значения экспрессии Galectin-3 были снижены и варьировали в пределах от 0,4 до 35,5%, а гистологически в данных случаях отмечались признаки доброкачественных изменений. Однако у 9 больных (17,6%) фолликулярными аденомами уровень экспрессии данного маркера был выше его порогового значения в 31,2%. У 3 пациентов с высокой экспрессией данного маркера (53,3, 58,3 и 66,4%) был диагностирован папиллярный, у 2 (54,3 и 89,9%) — фолликулярный РЩЖ.
Проведенный анализ выявления соматической мутации V600E гена BRAF методом полимеразной цепной реакции (ПЦР) в клеточном материале, полученном при ПТАБ из УОЩЖ, показал, что среди 46 пациентов с гистологически подтвержденным ВДРЩЖ данная мутация выявлена у 30 (65,2%) больных ПКЩЖ. При этом ВRАF-мутация исключена при фолликулярном РЩЖ, а также у всех 48 больных фолликулярными аденомами и 18 — коллоидным зобом. У 20 (66,7%) из 30 больных ВRАF-положительным РЩЖ выявлены его агрессивные формы с гистологическими признаками мультифокального роста опухоли (n=5), экстратиреоидной инвазии (n=10), поражения регионарных лимфоузлов (n=19). Изучение диагностической значимости позволило установить, что чувствительность, специфичность, точность, положительная и отрицательная прогностическая ценность выявления мутации V600E гена BRAF составили 65,2%; 100%; 84,8%; 100% и 80,5% соответственно.
Сопоставление дооперационных значений мембранной экспрессии NIS в пункционном материале с результатами окончательного гистологического исследования не выявило зависимости уровня экспрессии данного маркера от характера УОЩЖ (p<0,05).
Проведенный анализ результатов диагностики и хирургического лечения больных УОЩЖ показал, что у 219 (89,8%) оперативное вмешательство было оправданно и выполнено в адекватном объеме. Однако у 21 (8,6%) больного папиллярными микрокарциномами, фолликулярными аденомами и коллоидными узлами без признаков компрессии органов шеи были завышены показания к выбору операций радикального объема. Только у 4 (1,6%) пациентов потребовалось выполнение завершающей тиреоидэктомии с ЦЛАЭ после получения результатов окончательного гистологического исследования, свидетельствующих об экстратиреоидном распространении патологического процесса и наличии вторично измененных регионарных лимфатических узлов центральной группы.
Такой подробный ретроспективный анализ и оценка результатов диагностики и лечения УОЩЖ с учетом современных классификационных позиций, а также новых методов исследования, позволил нам разработать интегральную диагностическую шкалу, способствующую выбору оптимальной хирургической тактики.
Оригинальная шкала основывается на пятибалльной системе (от 0 до 4, где «0» — отсутствие, а «4» — высокий риск злокачественности) интерпретации результатов современных лабораторно-инструментальных исследований: УЗИ ЩЖ в рамках системы TIRADS; цитологического исследования пункционного материала в рамках системы Bethesda; методики полуколичественного анализа результатов двухиндикаторной сцинтиграфии ЩЖ с 99mТс-пертехнетатом и 99mТс-технетрилом; оценки уровня экспрессии онкомаркера Galectin-3 и выявлении мутации V600E гена BRAF в пункционном материале (табл. 1).
Комплексная оценка УОЩЖ с использованием оригинальной шкалы свидетельствует, что при количестве баллов от 0 до 5 риск злокачественности составляет 3–7%, от 6 до 10 баллов — 7–35%, 11–15 баллов — 35–80%, 16–20 баллов — 80–96%. Полученные результаты подтверждены данными корреляционного анализа — коэффициент ранговой корреляции Спирмена (ρ) равен 0,926 (р=0,00014), являясь показателем статистически значимой высокой тесноты связи.
Предложенная интегральная диагностическая шкала была внедрена в лечебно-диагностический алгоритм больных УОЩЖ, что позволило с высокой точностью стратифицировать риск их злокачественности и выработать обоснованный подход к определению дальнейшей тактики лечения больных (рис. 3).
Согласно указанному алгоритму пациентам с низким риском злокачественности образований при отсутствии признаков компрессии органов шеи показано динамическое наблюдение, а при их наличии — резекция ЩЖ в зависимости от вовлечения долей в патологический процесс. При выявлении УОЩЖ со средним риском злокачественности целесообразно выполнение гемитиреоидэктомии. Пациентам с повышенным риском злокачественности УОЩЖ целесообразно выполнение тиреоидэктомии с индивидуальным решением вопроса о ее дополнении профилактической ЦЛАЭ с учетом BRAF-статуса больного. При высоком риске злокачественности необходимо планировать радикальный объем хирургического вмешательства в объеме тиреоидэктомии с обязательной ЦЛАЭ.
Таблица 1. Интегральная диагностическая шкала комплексной оценки УОЩЖ
Методы исследования | Риск злокачественности, % | Кол-во баллов | |
Ультразвуковое исследование щитовидной железы в рамках системы TIRADS *(ρ=0,9646) | TIRADS 2 | 0 | 0 |
TIRADS 3 | 5,1 | 1 | |
TIRADS 4а | 22,2 | 2 | |
TIRADS 4b,c | 63,9 | 3 | |
TIRADS 5 | 88,2 | 4 | |
Цитологическое исследование пункционного материала в рамках системы Bethesda *(ρ=0,9338) | Bethesda I | – | 0 |
Bethesda II | 0 | 1 | |
Bethesda IV | 9,8 | 2 | |
Bethesda V | 85,7 | 3 | |
Bethesda VI | 92,5 | 4 | |
Двухиндикаторная сцинтиграфия щитовидной железы с 99mТс-пертехнетатом и 99mТс-технетрилом (индекс вымывания, %) *(ρ=0,9958) | >60 | – | 0 |
40–60 | 0 | 1 | |
20–40 | 25 | 2 | |
<20 | 100 | 4 | |
Оценка уровня экспрессии Galectin-3 (%) *(ρ=0,9266) | <20 | 5,4 | 0 |
20–40 | 8 | 1 | |
40–60 | 80,6 | 2 | |
60–80 | 91,6 | 3 | |
>80 | 100 | 4 | |
Выявление мутации V600E гена BRAF *(ρ=1) | не обнаружено | 19,8 | 1 |
обнаружено | 96,8 | 4 | |
*коэффициент ранговой корреляции Спирмена (ρ).
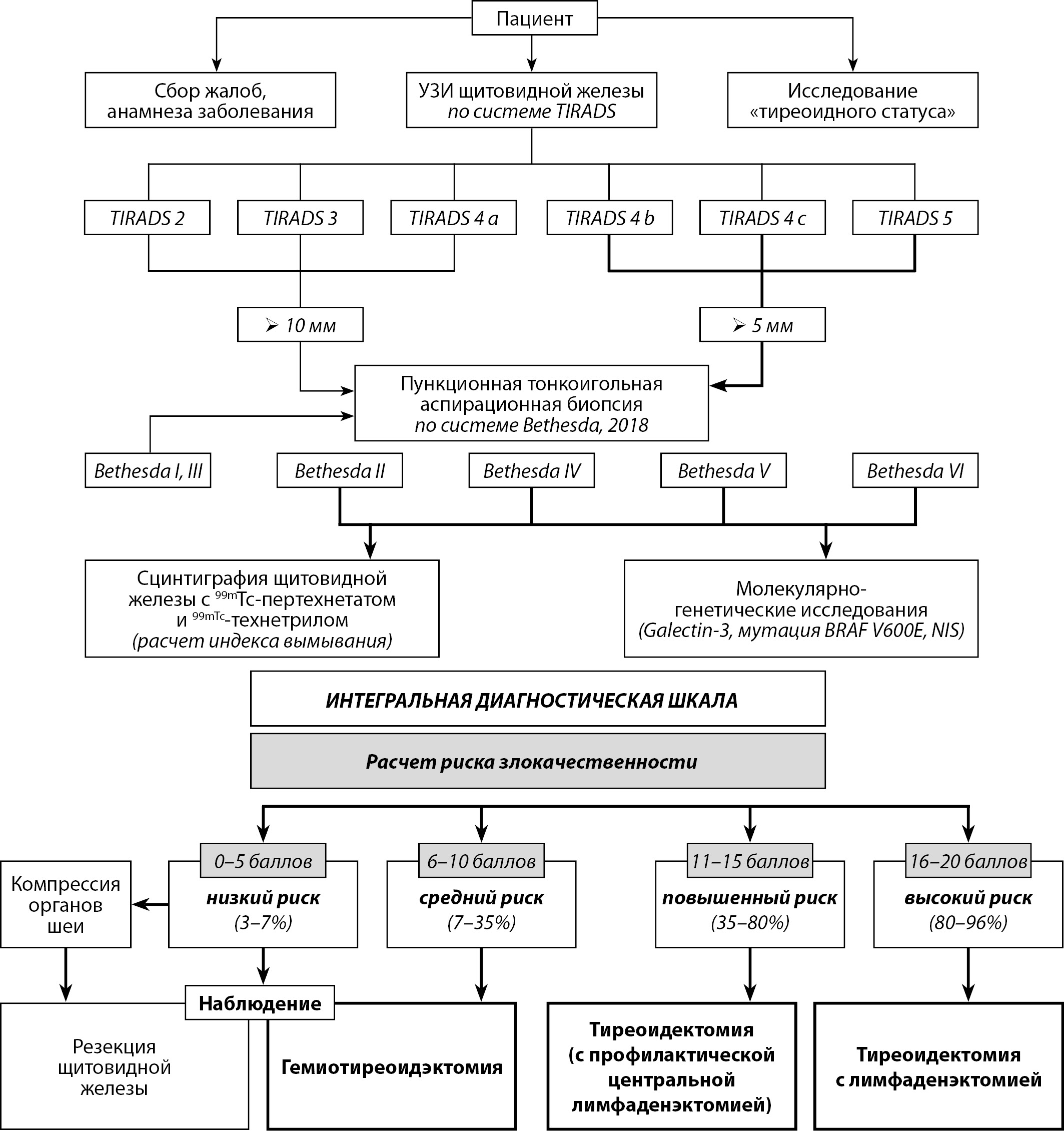
Рисунок 3. Модифицированный алгоритм диагностики и выбора варианта лечения больных узловыми образованиями щитовидной железы.
Проспективное исследование
Эффективность разработанной на предыдущем этапе исследования интегральной диагностической шкалы комплексной лабораторно-инструментальной оценки риска злокачественности УОЩЖ применительно к выбору оптимального варианта хирургического лечения оценена у 65 больных.
Результаты комплексного обследования позволили установить, что клинические проявления отсутствовали у 50 (76,9%) больных, компрессионный синдром и косметический дефект выявлены у 15 (23,1%), нарушение гормонального фона выявлено не было. У 3 (4,6%) пациентов отмечено наличие лабораторных признаков АИТ (повышение АТ-ТПО и АТ-ТГ более 60 Ед/л) без отклонений уровня ТТГ.
Выполнение УЗИ ЩЖ с описанием сонографической картины в рамках классификационной системы TIRADS всем больным позволило установить признаки злокачественного процесса (категории TIRADS 4a, b, c и 5) у 39 (60%) пациентов: один признак (TIRADS 4a) — у 12; 2 признака (TIRADS 4b) — у 12; 3 признака (TIRADS 4c) — у 7; 4–5 признаков (TIRADS 5) — у 8. Подозрительные ультразвуковые признаки в отношении шейных лимфатических узлов отмечены у 10 (15,4%) больных.
По результатам цитологического исследования клеточного материала, полученного при ПТАБ, с описанием заключений по категориям в рамках стандартизированной системы TBSRTC морфологические признаки ВДРЩЖ (Bethesda VI) или подозрения на него (Bethesda V) выявлены у 29 больных; фолликулярных неоплазий (Bethesda IV) — у 26; доброкачественных коллоидных узлов (Bethesda II) — у 10. Пациентам с I и III диагностическими категориями через 3 месяца были выполнены повторные ПТАБ, результаты цитологических заключений которых во всех случаях были отнесены в категорию доброкачественных УОЩЖ.
Молекулярно-генетическое исследование пункционного материала с оценкой Galectin-3 методом ПФЦ у всех больных позволило установить, что уровень его экспрессии колебался от 3,9 до 80,1% и в среднем составил 38,2±20,1%. Мутация V600E гена BRAF в аспирате УОЩЖ методом ПЦР выявлена у 14 (21,5%) больных с цитологически подтвержденным ВДРЩЖ (n=11) или подозрением на него (n=2) и фолликулярными неоплазиями (n=1).
Применение модифицированной методики динамической двухиндикаторной сцинтиграфии ЩЖ с 99mТс-пертехнетатом и 99mТс-технетрилом с полуколичественной оценкой полученных данных позволила отнести 4 (6,2%) пациентов к 1 модели, характеризующейся низким риском злокачественности. У 59 (90,8%) больных, соответствующих 2 и 3 моделям (промежуточному и высокому риску злокачественности) разброс индекса вымывания находился в пределах от 4,9% до 56,9% и в среднем составил 22,1±2,2%. При этом индекс поглощения РФП менее 20% отмечен у 31 пациента, от 20 до 40% — у 25, более 40% — у 5. У 2 больных применение сцинтиграфии ограничивал размер образований менее 10 мм.
Рентгеноскопия пищевода у 12 (18,5%) больных позволила выявить признаки компрессии органов шеи в виде сужения пищевода и смещения трахеи разной степени выраженности.
МСКТ шеи и груди с контрастным усилением выполнена 16 (24,6%) больным при ультразвуковом подозрении на экстратиреоидное распространение опухоли (n=2), ее размере более 4 см (n=4), а также увеличении регионарных лимфатических узлов (n=10). Данные, свидетельствующие о возможном распространении образования за пределы капсулы ЩЖ были получены во всех случаях. Признаки вторичной лимфаденопатии центральной группы шеи отмечены у 5 больных, боковой группы лимфоузлов шеи — у 4.
Комплексная оценка риска злокачественности УОЩЖ осуществлялась путем подсчета суммы баллов методов лабораторно-инструментального обследования. По результатам проведенного УЗИ ЩЖ с интерпретацией результатов в рамках международной классификационной системы TIRADS в оригинальной шкале 0 баллов присваивалось категории TIRADS 2; 1 балл — TIRADS 3; 2 балла — TIRADS 4a; 3 балла — TIRADS 4b и 4с; 4 балла — TIRADS 5. При оценке результатов цитологического исследования материала, полученного при ПТАБ, с описанием заключений в рамках категорий системы Bethesda 0 баллов соответствовало диагностической категории Bethesda I; 1 — Bethesda II; 2 — Bethesda IV; 3 — Bethesda V; 4 — Bethesda VI. С учетом полуколичественной оценки данных двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом с расчетом индекса вымывания 0 баллов присваивалось при его значении >60%, 1 — 40–60%, 2 — 20–40%; 4 — <20%. По результатам оценки уровня экспрессии Galectin-3 и наличия мутации V600E гена BRAF в пункционном материале, в рамках оригинальной шкалы 0 баллов имели УОЩЖ при уровне Galectin-3 <20%, 1 — 20–40%, 2 — 40–60%, 3 — 60–80%, 4 — >80%; выявление BRAF-мутации соответствовало 4 баллам, ее отсутствие — 1 баллу.
Полученные результаты комплексного обследования с присвоением баллов интегральной диагностической шкалы позволили уточнить предоперационный риск злокачественности УОЩЖ (табл. 2).
Сопоставление риска злокачественности УОЩЖ согласно интегральной диагностической шкале с результатами окончательной морфологической верификации позволило установить, что у всех больных с повышенным и высоким риском злокачественности (n=27) гистологически был подтвержден ВДРЩЖ. В то же время при высоком его уровне отмечали агрессивные формы рака в виде мультифокального роста опухоли (n=2), экстратиреоидной инвазии (n=4), поражения регионарных лимфоузлов шеи (n=7), а также наличия BRAF-мутации (n=14).
Доброкачественный характер УО был верифицирован у 36 (94,7%) из 38 пациентов с низким и средним риском малигнизации. Исключения составили 2 больных папиллярными микрокарциномами, имеющими средний риск злокачественности.
Реализация диагностической программы с применением интегральной диагностической шкалы позволила провести полноценную оценку патологических изменений в ЩЖ и тем самым определить объем хирургического вмешательства согласно рассчитанному риску злокачественности УОЩЖ (табл. 3).
Выполнение тиреоидэктомии у 2 (7,1%) больных со средним риском злокачественности образований было обусловлено сопутствующим патологическим процессом в другой доле ЩЖ в виде многоузлового коллоидного зоба с признаками компрессии органов шеи. В группе пациентов с повышенным риском малигнизации УОЩЖ показания к органосберегающей операции были обусловлены у одного больного BRAF-отрицательной фолликулярной опухолью.
При до- и интраоперационном подозрении на наличие метастазов в центральных (n=8) или боковых (n=4) лимфатических узлах шеи выполнена лечебная ЦЛАЭ или БЛАЭ, у 6 и 3 из которых подтвержден метастатический процесс в соответствующих группах. Профилактическая ЦЛАЭ, выполненная у 12 больных, была оправдана в 8 (66,7%) случаях, что подтверждает ее необходимость при высоком риске злокачественности или наличии признаков агрессивного течения заболевания.
Анализ применения методик операций показал, что с использованием традиционной открытой техники прооперированы 18 (27,7%) больных; MIVAT — 37 (56,9%); MIT — 10 (15,4%).
Результаты хирургического лечения больных свидетельствуют о единичных послеоперационных осложнениях — у 3 (4,6%) больных с клиническими и лабораторными признаками гипокальциемии и гипопаратиреоза, которые были купированы в течение месяца после операции назначением препаратов кальция с активными метаболитами витамина D. Применение ИОНМ позволило избежать повреждения ВГН с развитием нарушений функции гортани у всех пациентов.
На основании полученных данных можно констатировать, что применение интегральной дифференциально-диагностической шкалы комплексной оценки УОЩЖ с обязательным использованием как современных скрининговых, так и новых молекулярно-генетических методов исследования, позволило с точностью до 100% дифференцировать их характер, избежать необоснованных или повторных (завершающих) оперативных вмешательств у всех пациентов проспективного исследования, а также снизить частоту развития специфических осложнений в 2,8 раза (табл. 4).
Таблица 2. Распределение больных по риску злокачественности согласно интегральной диагностической шкале (n=65)
Сумма баллов | Число больных | Риск злокачественности | ||
абс. | % | |||
0–5 | 8 | 12,3 | 3–7% | низкий |
6–10 | 30 | 46,2 | 7–35% | средний |
11–15 | 13 | 20 | 35–80% | повышенный |
16–20 | 14 | 21,5 | 80–96% | высокий |
Таблица 3. Объем хирургических вмешательств у больных УОЩЖ проспективного исследования (n=65)
Объем хирургических вмешательств | Риск злокачественности (%) | |||
Низкий (n=8) | Средний (n=30) | Повышенный (35–80%) (n=13) | Высокий (80–96%) (n=14) | |
Тиреоидэктомия (n=28) | – | 2 | 12/6*/2** | 14/14*/2** |
Гемитиреоидэктомия (n=33) | 4 | 28 | 1 | – |
Субтотальная резекция ЩЖ (n=4) | 4 | – | – | – |
* — в том числе выполнена ЦЛАЭ;
** — в том числе выполнена БЛАЭ.
Таблица 4. Результаты оценки эффективности лечебно-диагностической тактики у больных УОЩЖ (n=309)
Критерии эффективности | Ретроспективная группа (n=244) | Проспективная группа | ||
абс. | % | абс. | % | |
Подтверждение предварительного диагноза | 221 | 90,5 | 65 | 100 |
Адекватный объем операции | 219 | 89,8 | 65 | 100 |
Необоснованный радикальный объем операции | 21 | 8,6 | – | – |
Недостаточный объем операции | 4 | 1,6 | – | – |
Послеоперационные осложнения | 31 | 12,8 | 3 | 4,6 |
Обсуждение
Оценка диагностической значимости современных скрининговых и новых лабораторно-инструментальных методов обследования доказала их уязвимость в дооперационной морфологической верификации УОЩЖ. Применение ультразвуковой классификационной системы TIRADS и цитологического исследования клеточного материала, полученного при ПТАБ, в рамках системы Bethesda позволяет с высокой чувствительностью (95,7 и 97,3% соответственно) уточнить характер патологических изменений ЩЖ. Однако другие показатели диагностической значимости данных методик резко снижаются с учетом выявления образований с неопределенным потенциалом злокачественности: специфичность указанных методик составила 50,7 и 22,4% соответственно. Высокие показатели информативности получены при изучении результатов двухиндикаторной сцинтиграфии ЩЖ с 99mТс-пертехнетатом и 99mТс-технетрилом, позволяющей на основании характера метаболизма туморотропного РФП в УОЩЖ определять их злокачественность с чувствительностью до 100%. Однако применение данной методики ограничивает размер образований менее 10 мм, находящихся ниже порога разрешения современных гамма-камер. Несмотря на постоянное совершенствование методов диагностики, применение новых молекулярно-генетических технологий показало их высокую эффективность в дооперационной диагностике и выборе оптимальной тактики лечения больных УОЩЖ. Так, Galectin-3 является высокочувствительным маркером ВДРЩЖ (95,7%), а мутация V600E гена BRAF — высокоспецифичным маркером ПКЩЖ (100%) с нередким развитием их агрессивных форм, что позволяет обосновать наиболее рациональный вариант хирургического лечения (табл. 5). Полученные данные согласуются с литературными и свидетельствуют о том, что выявленная склонность к более агрессивному течению BRAF-положительного ПРЩЖ требует рассмотрения вопроса о выполнении радикального объема хирургического вмешательства — тиреоидэктомии и ЦЛАЭ даже при микрокарциномах. При этом отсутствие данной соматической мутации позволяет планировать органосберегающий объем операции на ЩЖ [14–16].
Таблица 5. Информативность методов диагностики УОЩЖ (%, p<0,05)
Показатель информативности | УЗИ ЩЖ | ПТАБ | Сцинтиграфия ЩЖ с 99mТс-пертехнетатом и 99mТс-технетрилом | Молекулярно-генетические методики | ||
визуальная методика | полуколичественная методика | Galectin-3 | BRAF V600E | |||
Чувствительность | 95,7 | 97,3 | 62,5 | 100 | 95,7 | 65,2 |
Специфичность | 50,7 | 22,4 | 85,7 | 80 | 86,4 | 100 |
Точность | 66 | 45,1 | 73,3 | 92,3 | 90,2 | 85,7 |
Положительная прогностическая ценность | 50 | 35,3 | 83,3 | 88,9 | 83,0 | 100 |
Отрицательная прогностическая ценность | 95,8 | 95 | 66,7 | 100 | 96,6 | 80,5 |
Проведенный анализ мембранной экспрессии NIS не подтвердил целесообразность его применения в рамках молекулярно-генетической панели с целью дифференциальной диагностики доброкачественных и злокачественных УОЩЖ. Накопленный опыт клинических исследований об изучении прогностической ценности NIS в отношении радиойодрезистентности РЩЖ свидетельствует о возможности использования данного маркера с целью оценки эффективности послеоперационной PЙT ввиду снижения способности тиреоцитов к захвату йода. Низкая мембранная экспрессия натрий-йодидного симпортера позволяет спрогнозировать плохой лечебный эффект от терапии радиоактивным йодом, что определяет показания для выполнения тиреоидэктомии с профилактической ЦЛAЭ ввиду повышенного риска рецидива BДPЩЖ даже после комбинированного лечения [17][18].
Таким образом, проведенное исследование демонстрирует, что используемые в настоящее время методы обследования больных УОЩЖ обладают разными показателями информативности и не могут иметь самостоятельного решающего значения в их диагностике. Это может привести в некоторых случаях к гипо- или гипердиагностике заболевания и, соответственно, к выбору неадекватного объема операций или их необоснованному выполнению. Указанная в модифицированном алгоритме концепция диагностики и лечения подчеркивает необходимость комплексного подхода к оценке патологических изменений в ЩЖ, определяющего индивидуализированный выбор оптимального объема хирургического вмешательства.
Заключение
Таким образом, многокомпонентный анализ результатов лечения больных УОЩЖ показывает целесообразность комплексного системного подхода к оценке всех диагностических данных и аргументированному выбору объема хирургического вмешательства. Применение в лечебно-диагностическом алгоритме предложенной интегральной шкалы комплексной лабораторно-инструментальной оценки образований позволяет с высокой точностью стратифицировать риск их злокачественности, уточнить морфологический потенциал и планировать адекватный объем операции.
Дополнительная информация
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Абдрашитова А.Т., Панова Т.Н., Дьякова О.Н. и др. Подходы к ранней диагностике рака щитовидной железы // Кубанский научный медицинский вестник. — 2018. — Т. 25. — №3. — С. 139-148.
2. Erkinuresin T, Demirci H. Diagnostic accuracy of fine needle aspiration cytology of thyroid nodules. Diagnosis (Berl). 2020;7(1):61-66. doi: https://doi.org/10.1515/dx-2019-0039
3. Avior G, Dagan O, Shochat I et al. Outcomes of the Bethesda system for reporting thyroid cytopathology: Real-life experience. Clin Endocrinol (Oxf). 2021;94(3):521-527. doi: https://doi.org/10.1111/cen.14341
4. Щеголев A.A., Пантелеев И.В, Ларин А.А. и др. Пункционная тонкоигольная аспирационная биопсия узлов щитовидной железы: сравнительная оценка цитологического и гистологического заключений // Лечебное дело. — 2021. — №3. — С. 120-124. doi: https://doi.org/10.24412/2071-5315-2021-12367
5. Bongiovanni M, Kakudo K, Nobile A, et al. Performance comparison in the «follicular-neoplasm» category between the American, British, Italian and Japanese systems for reporting thyroid cytopathology. Journal of Basic & Clinical Medicine. 2015;4(2):42-45
6. Ромащенко П.Н., Майстренко Н.А., Бойков И.В. и др. Дифференциальная диагностика фолликулярных неоплазий с использованием динамической двухиндикаторной сцинтиграфии щитовидной железы // Таврический медико-биологический вестник. — 2020. — Т. 23. — №2. — С. 172-180. doi: https://doi.org/10.37279/2070-8092-2020-23-2-172-180
7. Сергийко С.В., Лукьянов С.А., Титов С.Е. и др. Современные тенденции, парадигмы и заблуждения в диагностике и лечении узловых образований щитовидной железы // Таврический медико-биологический вестник. — 2021. — Т. 24. — №2. — С. 150-155. doi: https://doi.org/10.37279/2070-8092-2021-24-2-150-155
8. Яновская Е.А., Беляков И.Е., Александров Ю.К., Яновская М.Е. Комплексная оценка при узловой патологии щитовидной железы // Здоровье и образование. — 2017. — Т. 19. — №8. — С. 13-17.
9. Krane JF, Cibas ES, Endo M, et al. The Afirma Xpression Atlas for thyroid nodules and thyroid cancer metastases: Insights to inform clinical decision-making from a fine-needle aspiration sample. Cancer Cytopathol. 2020;128(7):452-459. doi: https://doi.org/10.1002/cncy.22300
10. Lupo MA, Walts AE, Sistrunk JW, et al. Multiplatform molecular test performance in indeterminate thyroid nodules. Diagn Cytopathol. 2020;48(12):1254-1264. doi: https://doi.org/10.1002/dc.24564
11. Ромащенко П.Н., Майстренко Н.А., Криволапов Д.С., Симонова М.С. Молекулярно-генетические исследования в хирургии щитовидной железы // Таврический медико-биологический вестник. — 2021. — Т. 24. — №2. — С. 118-126. doi: https://doi.org/10.37279/2070-8092-2021-24-2-118-126
12. Бельцевич Д.Г., Мудунов А.М., Ванушко В.Э. и др. Дифференцированный рак щитовидной железы: клинические рекомендации / Общероссийский национальный союз «Ассоциация онкологов России» и др. — Москва: Министерство здравоохранения Российской Федерации, 2020. — 46 с.
13. Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133. doi: https://doi.org/10.1089/thy.2015.0020
14. Борискова М.Е. Фарафонова У.В., Панкова П.А. и др. Оптимизация хирургической тактики лечения BRAF-положительного папиллярного рака щитовидной железы // Клиническая и экспериментальная тиреоидология. — 2018. — Т. 14. — № 1. — С. 25-33. doi: https://doi.org/10.14341/ket9424
15. Симонова М.С., Криволапов Д.С. Роль молекулярно-генетических маркеров в дооперационной диагностике и выборе хирургической тактики у больных фолликулярными неоплазиями и высокодифференцированным раком щитовидной железы // Известия Российской Военно-медицинской академии. — 2021. — Т. 40. — №S1-3. — С. 292-296.
16. Mady LJ, Grimes MC, Khan NI, et al. Molecular Profile of Locally Aggressive Well Differentiated Thyroid Cancers. Sci Rep. 2020;10(1):8031. doi: https://doi.org/10.1038/s41598-020-64635-8
17. Ромащенко П.Н., Криволапов Д.С., Симонова М.С. BRAFмутация в дифференциальной диагностике и выборе хирургической тактики у больных новообразованиями щитовидной железы // Национальная Ассоциация Ученых. — 2022. — № 74. — С. 18-23. doi: https://doi.org/10.31618/nas.2413-5291.2022.3.75.561
18. Tavares C, Coelho MJ, Eloy C, et al. NIS expression in thyroid tumors, relation with prognosis clinicopathological and molecular features. Endocr Connect. 2018;7(1):78-90. doi: https://doi.org/10.1530/EC-17-0302
Об авторах
П. Н. РомащенкоРоссия
Ромащенко Павел Николаевич - д.м.н., профессор, член-корр. РАН.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. А. Майстренко
Россия
Майстренко Николай Анатольевич - д.м.н., профессор, академик РАН.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Д. С. Криволапов
Россия
Криволапов Денис Сергеевич - к.м.н.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. С. Симонова
Россия
Симонова Мария Сергеевна
194044, Санкт-Петербург, ул. Академика Лебедева, д. 6
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
Рецензия
Для цитирования:
Ромащенко П.Н., Майстренко Н.А., Криволапов Д.С., Симонова М.С. Интегральная диагностическая шкала в хирургии щитовидной железы. Эндокринная хирургия. 2024;18(3):12-23. https://doi.org/10.14341/serg12841
For citation:
Romashchenko P.N., Maistrenko N.A., Krivolapov D.S., Simonova M.S. Integral diagnostic scale in thyroid surgery. Endocrine Surgery. 2024;18(3):12-23. (In Russ.) https://doi.org/10.14341/serg12841

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).










































